REAZIONI DEL FUSO
La fusione di un vetro è definibile come quel processo di trasferimento di calore alla miscela di fusione o mucchio che è definibile come una , massa di materiali sotto forma di polvere o granulare con diverse dimensioni particellari medie; il trasferimento avviene con tre modalità:
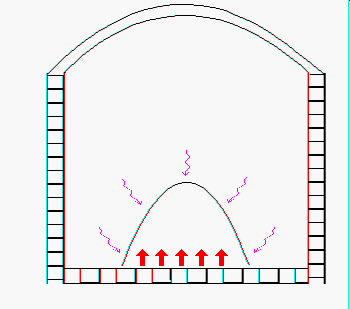
E’ stato visto che i ¾ del mucchio vengono fusi per conduzione termica attraverso l’atmosfera del forno e la fiamma dei bruciatori e per irraggiamento da parte della volta del refrattario (figura 1).
Figura 1

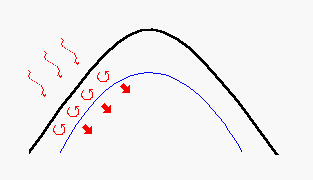
Successivamente si instaurano dei moti convettivi sullo strato superficiale fuso del mucchio che favoriscono un efficace riscaldamento per conduzione termica degli strati interni non ancora fusi come vediamo dalla figura 2.
Le correnti convettive del fuso hanno moti convettivi resi complessi dalla formazione, specie nei primi stadi della fusione, dalla formazione di fasi liquide eterogenee e a diversa densità oltre che dallo sviluppo di notevoli quantità di gas.
Figura 2
Variabili che condizionano il processo di fusione
1)Forma del mucchio : determina la quantità di calore assorbito, la capacità del fuso di fluire e quella dei gas prodotti dalle reazioni chimiche di abbandonare il sito di reazione
2)Materie prime : 2.1) composizione chimica
2.2) distribuzione granulometrica
3)Reattività dei materiali La reattività dei materiali dipende alla forma fisica in cui si trovano, ad esempio un quarzo può essere aggiunto nella miscela di fusione sotto forma di sabbia, farina, micronizzato, silice colloidale ecc..
4)Contenuto di umidità L’aggiunta di acqua al mucchio di fusione riduce i fenomeni di segregazione fisica e può favorire lo sviluppo di reazioni sub-solidus (reazioni idrotermali ecc..)
5)Stato fisico dei materiali Il processo di pellettizzazione o di granulazione aumenta la densità dei materiali e favorisce l’assorbimento del calore accelerando il processo di fusione
6)Atmosfera del forno A parità di profilo termico una fusione effettuata in un forno a gas ha caratteristiche diverse da quella in un forno elettrico, nel secondo caso infatti siamo in presenza di un processo di fusione che avviene in una atmosfera statica.
7)Storia termica in una fusione industriale siamo in presenza di una grande massa di materiale che subisce un processo di fusione fuori dell’equilibrio termico, per evitare inconvenienti tipo una grande disomogeneità nella fusione con conseguenze che si riflettono anche sulla composizione del fuso si tende ad operare presinterizzazioni e preriscaldamenti dei materiali in modo da iniziare il processo di fusione vero e proprio con la massima omogeneità delle caratteristiche chimico-fisiche del mucchio
Processo di fusione
Nel processo di fusione si distinguono in genere 3 stadi
I STADIO DELLA FUSIONE
1) rimozione H2O
l’acqua di adsorbimento (umidità) viene completamente rimossa in questo stadio della fusione la decomposizione dell’acqua inizia a circa 50°C e raggiunge una velocità massima a 100°C, l’acqua assorbita fisicamente può continuare a essere presente fino a temperature di circa 400°C , l’acqua legata chimicamente o di cristallizzazione può allontanarsi anche a temperature più elevate (per argille e caolini si arriva ad un limite di temperatura di 600°C).
2) combustione della materia organica
in questa fase tutta la materia organica compresi eventuali riducenti utilizzati nell'industria come zuccheri o acido formico viene distrutta
3) reazioni idrotermali
nel primo stadio della fusione avvengono reazioni idrotermali sub-solidus favorite dalla presenza di vapor acqueo in questo modo grandi quantità di SiO2 possono essere convertite in silicati di sodio. In batch per fusioni di vetri sodico-calcici si osserva la formazione (intorno a 450°C) di carbonati doppi idrati di sodio e calcio e di idro silicati di calcio
![]()
![]()
![]()
la reazione avviene a circa 850°C ma già a 400°C si può formare carbonato doppio di sodio
![]()
La wollastonite che in condizioni normali si dovrebbe formare temperature di 1350°C-1400°C in presenza di Na2CO3 inizia a formarsi già a 850°C-950°C
Reazioni del carbonato di sodio con la silice:
![]() metasilicato
metasilicato
![]() disilicato
disilicato
![]() ortosilicato
ortosilicato
la reazione del carbonato di sodio con la silice dipende dalla dimensione particellare, infatti si va da un temperatura inferiore di 300°C in presenza di particelle di dimensioni di circa 1 m fino ad una temperatura di 700°C per particelle di dimensioni maggiori (300 m ).
![]()
il minio di piombo si decompone in litargirio giallo con evoluzione di ossigeno
![]()
intorno ai 700°C lo zinco ossido reagisce completamente con la SiO2 per dare silicato di zinco che poi fonde molto facilmente
In questo stadio di fusione si possono avere passaggi tra fasi polimorfe , un esempio è dato dal passaggio reversibile a 573°C da quarzo a a quarzo b o le inversioni cristalline del NaCO3 a 345 °C e 476 °C e del NaNO3 a 285 °C
Nel primo stadio della fusione avvengono le cosiddette reazioni sub-liquidus : sono reazioni chimiche che hanno luogo a temperature inferiori a quelle in cui si osserva la comparsa del fuso e che quindi coinvolgono fasi solide o gassose. Queste reazioni sono guidate da meccanismi di trasferimento di calore , dal trasferimento di massa (come la diffusione di volume o superficiale) e dalla velocità di evoluzione dei gas prodotti, esse sono fortememente influenzate dalla natura chimico fisica e dalla storia termica del mucchio (se esso ha subito una presinterizzazione, un preriscaldamento oppure un processo di pellettizzazione ecc..).
Se il riscaldamento è molto rapido si possono considerare trascurabili, tuttavia se le materie prime sono di dimensioni granulometriche ridotte, in forma sufficientemente dispersa e il tempo di riscaldamento è lungo, queste possono essere responsabili della conversione della maggior parte della silice libera e della decomposizione della maggior parte dei carbonati
II STADIO DELLA FUSIONE
In questa fase inizia il processo di fusione nel quale sono coinvolti con interazioni complesse i costituenti originali del batch di partenza, i prodotti intermedi originati dalle reazioni sub-liquidus e la fase liquida di neoformazione.
Si hanno reazioni tra particelle di solidi cristallini e fusi di sali inorganici, con fusi di fasi vetrose di nuova formazione o con entrambi i componenti; in questa fase della fusione i liquidi che reagiscono con le sostanze cristalline possono avere viscosità anche molto diverse tra loro: i sali fusi infatti possono avere viscosità anche molto basse, dell’ordine degli 0,1 Poise mentre i fusi vetrosi possono arrivare nella fattispecie a viscosità anche di sei ordini di grandezza superiori.
Il fuso primario in genere bagna la superficie dei solidi favorendo la riprecipitazione di ulteriori fasi cristalline, naturalmente la diffusione della fase fusa nella massa di reazione è ostacolata dalla presenza di questi precipitati ma in genere procede con facilità favorita dalla evoluzione dei gas e da gradienti di tensione superficiale tra fusi di diversa natura.
Quando la quantità complessiva del fuso aumenta entrano in gioco la viscosità e la tensione superficiale dei fusi e si potrà avere la interconnessione delle gocce e dei films superficiali in aree sempre più vaste.
Con l’aumento del grado di interconnessione della fase liquida la porosità della massa in fusione tende a diminuire considerevolmente, in questo caso la presenza di fusi con valori molto bassi di tensione superficiale può portare alla formazione di schiume di volume considerevole.
Effetto di addizione di promotori di fusione
La temperatura di fusione può essere abbassata aggiungendo sostanze che agiscono da promotori del processo di fusione ( K2CO3 e LiCO3 favoriscono l’evoluzione di CO2 dal fuso durante la fusione di vetro sodio-calcici).
Reazione SiO2-NaCl-Na2CO3
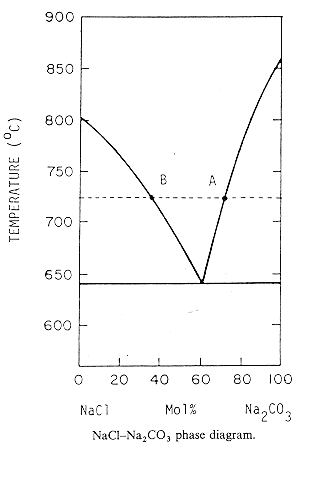
Dalla figura 3 (§ 1) vediamo la reazione del carbonato di sodio con un sale inorganico aggiunto al batch in piccole quantità (agente promotore della fusione).
Ad una temperatura T compresa tra la temperatura di eutettico e quella di fusione dei sali puri si avrà Na2CO3 solido ed un fuso del sale inorganico (NaCl) saturato con Na2CO3 (punto A).
In presenza di SiO2 il sodio presente nel fuso reagisce per formare disilicato di sodio e quindi ulteriore Na2CO3 si dovrà dissolvere nel fuso per compensare quello che è stato perso per reazione con la SiO2.
Dopo che tutto il carbonato di sodio è fuso, questo si comincia ad impoverire di sodio finché non viene raggiunto il limite di saturazione del NaCl (B). A questo punto la composizione del fuso rimarrà costante e quindi mano a mano che il NaCO3 verrà consumato per reazione con la SiO2 ulteriore NaCl precipiterà dal fuso.
Quando tutto il carbonato di sodio carbonato sarà consumato la miscela finale sarà dunque costituita da SiO2 in eccesso, dal cloruro di sodio e da silicati di sodio. In questo caso la dimensione delle particelle influenza fortemente la temperatura di reazione, è stato osservato che per particelle di 50 m di diametro medio la temperatura in cui è massima la velocità di conversione si può abbassare anche di 80°C rispetto alla temperatura di conversione tipica di particelle con diametro medio di 200 m.
Figura 3 Diagramma di stato NaCl-Na2CO3
Reazione SiO2-NaNO3
Il nitrato di potassio reagisce con la silice SiO2 a 500°C con una velocità di conversione che raggiunge il massimo intorno a 720°C quando le dimensioni particellari medie sono di circa 50 m, le temperature salgono a 790 °C quando le dimensioni delle particelle raggiungono il diametro medio di 150-200 m
Effetto diluizione: presenza di due sali a comune
Quando si ha la presenza di due sali non inerti si osserva la formazione di un fuso a temperatura inferiore a quella prevedibile con il diagramma di stato, questo fenomeno è dovuto all’effetto di mutua diluizione dei due sali.
Come esempio possiamo prendere il sistema NaNO3+Na2CO3, in miscela il componente meno reattivo (Na2CO3) inizia a reagire ad una temperatura inferiore a quella caratteristica mentre quello più reattivo (NaNO3) reagisce meno vigorosamente del previsto. Il risultato è quello di avere una temperatura iniziale della reazione inferiore a quella teorica ed una temperatura di fine reazione superiore.
Questo effetto anche se ha il vantaggio di anticipare la temperatura di formazione dei fusi salini e quindi anche la temperatura di formazione del fuso vetroso ha lo svantaggio di far cedere al sistema CO2 a temperature relativamente alte (anche superiori a 1000°C in certi casi) e quindi a far aumentare il rischio di formazione di schiume.
Un metodo generale per evitare la formazione di schiume è quello di utlizzare materie prime in dimensioni granulometriche inferiori anche se in questo caso si può incorrere nel rischio di aumentare in maniera eccessiva la reattività dei sistemi a bassa temperatura con il rischio di fasi di neoformazione più refrattarie dei componenti di partenza.
Reazione Na2CO3-K2CO3-SiO2
Gli ioni sodio diffondono con facilità sulla superficie del grano di silice e quindi aiutano il carbonato di potassio ad agire su superfici più estese favorendo la reazione del potassio con la silice in profondità (con formazione di silicati misti) e quindi la fusione del grano.
Reazione Na2CO3-CaCO3-(Ca,Mg)CO3
A circa 500°C si ha la formazione di carbonati doppi di sodio e calcio e questo provoca nel sistema ternario Na2CO3-CaCO3-(Ca,Mg)CO3 la scomparsa dal batch di reazione del calcio carbonato compreso quello legato nella dolomite lasciando così libero il MgCO3 di decomporre intorno a 630°C.
In questo modo si può evitare una evoluzione della CO2 alla temperatura di decomposizione termica del carbonato di calcio (intorno ai 900°C).
L’atmosfera di fusione è importante per il suo effetto sulla decomposizione della CO2, evidentemente alte pressioni parziali di gas impediscono una decomposizione completa a bassa temperatura.
Reazione SiO2-Na2CO3
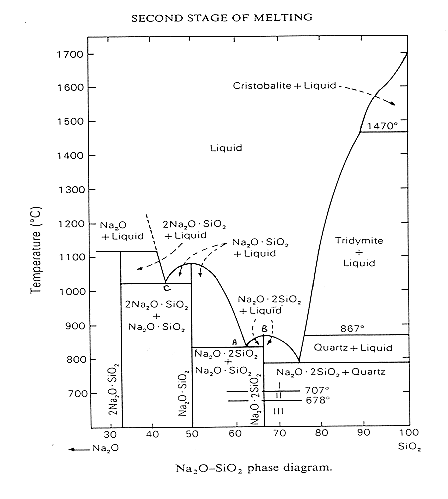
Nella figura 4 possiamo vedere il diagramma di stato SiO-Na2O, a circa 850°C (A) appare il fuso dell’eutettico tra metasilicato di sodio e disilicato di sodio, sopra gli 875°C non si osserva più la presenza di sodio disilicato (B) mentre sopra 1020°C si ha un esteso range di silicati fusi (a 1020°C c’è l’eutettico ortosilicato-metasilicato (C).
In sostanza si può schematizzare questa reazione in due stadi:
L’equilibrio di questa reazione dipende dalla temperatura e dal rapporto silice-carbonato di sodio.
Figura 4 Diagramma di stato Na2O-SiO2
Fusi di glass-forming
In assenza di promotori della fusione la fase vetrosa che si forma nel secondo stadio della fusione può essere molto ricca in vetro-formatori. In questo caso la progressione del processo di fusione è stabilita dalla cinetica di dissolvimento delle particelle solide nel fuso, la reazione è guidata in questo caso dalla superficie specifica delle particelle di quarzo (SiO2), dalla pressione parziale dei gas evoluti, dalla distribuzione granulometrica e dalla densità.
In figura 5 è riportato un quadro riassuntivo delle principali reazioni di fusione che avvengono nel secondo stadio di reazione in un batch di materie prime per la fusione di vetro piano:
Figura 5 Principali reazioni di formazione di fusi in miscele per vetro sodio-calcio-silicatico

Effetto dei rottami di vetro
All’aumentare della quantità di rottame si osserva una diminuzione della temperatura di evoluzione dei gas dalla miscela di fusione: in questo caso essa può essere favorita dalla maggiore facilità con cui i gas possono sfuggire dal sito di reazione infatti i rottami vetrosi hanno una temperatura di rammollimento piuttosto alta e questo permette al mucchio di conservare una certa porosità.
C’è naturalmente un limite superiore alla quantità di rottame utilizzato e questo è dato dalla aggressione che il rottame fuso esercita sulle pareti del refrattario durante le fasi di riscaldamento della miscela di fusione: infatti si deve considerare che ad alta temperatura il fuso derivato da questi rottami presenta una viscosità molto bassa e se è presente in grande quantità non riesce a miscelarsi in maniera adeguata con il fuso primario formatisi dalla fusione delle materie prime.
Mediamente la quantità di vetro riciclato utilizzato in una fusione è dell’ordine del 10-20% della massa totale.
Storia termica
Nella parte finale del secondo stadio di fusione la presenza di particelle di sostanze refrattarie (e quindi la loro capacità di dissoluzione nel fuso formatisi) è influenzata dal tipo di processo subito dal batch di fusione cioè , in definitiva, dalla sua storia termica.
Con un basso gradiente di salita della temperatura si ha un alto grado di conversione delle materie prime e questo può portare alla formazione di silicati refrattari o comunque a fusi con alto contenuto di silice cioè molto viscosi a bassa temperatura.
Un alto gradiente di salita della temperatura non permetterà, d’altro canto, il completo sviluppo delle reazioni chimiche con la conseguenza che fusi salini potranno essere presenti anche a temperature alte: alla fine si potranno avere grani di sostanze refrattarie immersi in fusi poco viscosi o presenza di fusi immiscibili.
Un ciclo termico ottimale per una completa dissoluzione dei grani probabilmente è un compromesso tra questi estremi.
Nella realtà il secondo stadio della fusione difficilmente porta alla fusione completa del batch, si troveranno sempre grani di silice e di altri ossidi refrattari dispersi nel fuso.
III STADIO DELLA FUSIONE
La permanenza di grani di ossidi refrattari ad alta temperatura in un fuso dipende dal loro limite di solubilità e dalla diffusione che a sua volta è controllata dalla composizione chimica del fuso che circonda la particella solida.
Alle alte temperature del fuso si hanno viscosità molto basse, si può quindi sfruttare questo fenomeno per favorire i processi diffusivi tra fuso e grano.
I cosiddetti agenti di refining permettono una forte evoluzione di gas proprio alle alte temperature alle quali la viscosità del fuso è bassa, questo da luogo ad un forte rimescolamento del fuso favorendo la diffusione degli atomi del grano refrattario nella fase fusa.
Gli agenti di refining hanno anche la funzione di eliminare bolle di gas che sono rimaste intrappolate nel fuso e di ridurre la sovrasaturazione dei gas che altrimenti, disciolti nel fuso ad alta temperatura, formerebbero bolle durante la fase di raffreddamento.
In questa fase è critica l’interazione del fuso con le pareti e il fondo del forno che può portare a fenomeni di "ribollitura" con formazione di nuove bolle o alla evaporazione di composti volatili.
In definitiva gli agenti di refining hanno lo scopo di eliminare bolle di gas residue e di ridurre la sovrasaturazione dei gas, inoltre essi stessi producono gas che hanno la funzione di rimesolare ed omogeneizzare la massa fusa oltre che funzionare da "gas di lavaggio" per le bolle presenti.
Tipici agenti di refining sono gli ossidi del V gruppo : As2O3 e Sb2O3 anche se adesso l’utilizzo del primo è stato eliminato a causa della sua elevata tossicità.
Le reazioni di queste sostanze nel batch di fusione sono molto complesse come possiamo vedere negli schemi sotto riportati dove come esempio è mostrata la reazione tra As2O3 , NaNO3 e Na2CO3
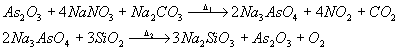
con D 2 > D 1
A temperature più alte si ha una ossidazione intorno a 1000°C con formazione di As2O5 e quindi una decomposizione a temperatura superiore ai 1250-1300°C con evoluzione di O2:
![]()
Esempi di forni industriali da vetro
Figura 6 disegno di un forno a bacino intermittente
In figura si noti tra la zona di fusione del mucchio (a) e quella di raffinamento del fuso (b) una gola (c) che serve a far raffreddare il fuso fino ad una viscosità adatta alla formatura successiva (d)
Il rapporto tra la lunghezza L e larghezza B del forno deve essere calcolata in modo da raggiungere un corretto profilo longitudinale di temperatura , la larghezza deve inoltre essere sufficiente a permettere una combustione efficiente (nel caso di forni a gas) ma non tale da compromettere la stabilità della volta.
In genere il rapporto ![]() per forni di piccole-medie dimensioni (20 m3) è circa 1,2 mentre per forni di grandi dimensioni (90 m3) può arrivare a 2,3.
per forni di piccole-medie dimensioni (20 m3) è circa 1,2 mentre per forni di grandi dimensioni (90 m3) può arrivare a 2,3.
La profondità del fuso deve essere progettata in modo da impedire un raffreddamento degli strati interni del fuso e contemporaneamente permettere moti convettivi di calore, inoltre particolare cura deve essere messa affinché il refrattario del fondo non si riscaldi troppo divenendo sensibile a fenomeni di corrosione. La profondità del fuso è anche legata direttamente alla trasparenza del fuso alla radiazione infrarossa e comunque non eccede mai i limiti inferiori e superiori di 0,75-1,3 m.
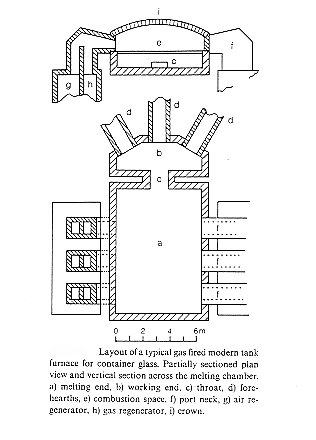
In figura vediamo il disegno di un forno elettrico, nel fuso la resistività elettrica è sufficientemente bassa da permettere passaggio di corrente e quindi riscaldamento per effetto Jaule.
Gli elettrodi sono costituiti in molibdeno o stagno, il vantaggio della fusione elettrica è quello che si evita la formazione di grandi volumi di gas di combustione e la emissione di elementi nocivi o tossici volatili come fluoro, boro, piombo.
Figura 7 forno elettrico
Il tempo di residenza di un fuso in forni di medie dimensioni (20m3) è generalmente di 50-60 h con un massimo intorno a 20-30 h ,anche se viene osservato nei cambi di produzione un residuo di fuso "vecchio" anche dopo 200 h.